【オンコロジーパイプライン】武田薬品を徹底分析してみる

業界内でも注目されるオンコロジー領域。
今回は武田薬品工業の開発パイプラインから、
将来性について少し分析してみます。
武田薬品のオンコロジーパイプラインについて少し調べてみました。武田のオンコロジーっていつも求人かかってるけど、なんでもいい人がいたら採りたい「厳選採用」ってやつらしいです。ずっと求人でてると人気ないのかなって思っちゃいますが。https://t.co/NYsMrWnOfA
— ケースケ (@Keisukemrlifeh1) October 13, 2018
実は武田薬品はオンコロジーMRの募集が常にかかっているんですよね。
オンコロジーパイプラインの開発状況は?
今開発している薬剤がそんなに画期的なのか?
今回はこの辺りについて、具体的に分析していきます。
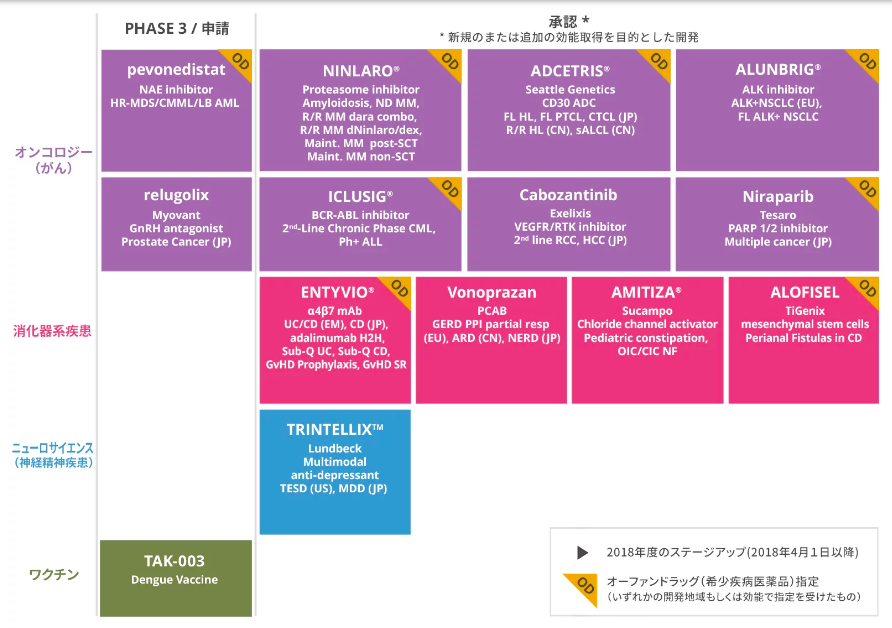
ニンラーロ®︎(イキサゾミブ)
国内承認日:2017年3月30日
国内におけるピークセールス
予測年度:10年度
予測本剤投与患者数 : 2.2千人
予測販売金額 :164億円(ピーク時)
グローバル予想:30 billion $(およそ3,300億円)
代表的な臨床試験
TOURMALINE-MM1
レナリドミド及びデキサメタゾンに本剤を併用投与することにより、主要評価項目である無増悪生存期間(PFS)が、プラセボを併用した場合と比較して統計学的有意延長。
ハザード比0.74、p=0.01、
PFSの中央値はイキサゾミブ群20.6ヶ月 vs プラセボ14.7ヶ月
そのほか進行中の試験は以下の通りです。
TOURMALINE-MM1:再発・難治性の多発性骨髄腫を対象に本剤・レナリドミド・デキサメタゾン併用群とプラセボ・レナリドミド・デキサメタゾン併用群を比較(上記紹介済み)
TOURMALINE-MM2:初発の多発性骨髄腫を対象に本剤・レナリドミド・デキサメタゾン併用群とプラセボ・レナリドミド・デキサメタゾン併用群を比較
TOURMALINE-MM3:初発の多発性骨髄腫を対象に導入療法及び自家造血幹細胞移植後の維持療法として本剤とプラセボを比較
TOURMALINE-MM4:自家造血幹細胞移植歴のない初発の多発性骨髄腫を対象に維持療法として本剤とプラセボを比較
TOURMALINE-AL1: 再発・難治性のALアミロイドーシスを対象に本剤及びデキサメタゾンの併用と医師が選択したレジメンでの治療を比較
現在の適応は「再発又は難治性の多発性骨髄腫」であり、
基本2nd line以降の投与となります。
武田薬品はベルケイド®︎も扱っているので、初発はベルケイド®︎、
再発時にニンラーロ®︎+レナリドミドの組み合わせを推奨していると思われます。
初回レナリドミドを使用させないような戦略も兼ねていますが、
現在の売上高からすると苦戦しているのではないでしょうか?
いずれにしても多発性骨髄腫の分野は、初発治療が取れるかどうかなので、
今後の臨床試験の結果に期待ですね。
ニンラーロ®︎、レブラミド®︎、デキサメタゾンのALL経口レジメンも期待できそうです。
アドセトリス®︎(ブレンツキシマブ ベドチン)
国内承認日:2014年1月17日
国内におけるピークセールス
予測年度:10年度
予測本剤投与患者数 : 300人
予測販売金額 :22.1億円(ピーク時)
グローバル予想:1.45 billion $(およそ1,600億円)
代表的な臨床試験
ECHELON-1
ホジキンリンパ腫の標準的な一次治療として知られている、ABVD(ドキソルビシン+ブレオマイシン+ビンブラスチン+ダカルバジン)療法 vs アドセトリスAVD療法(ABVDからブレオマイシンを除いた療法)の比較試験。
アドセトリスAVD群は対照群と比較して統計学的有意に修正無増悪生存期間の延長が認められる
(ハザード比:0.770、p値=0.035)。
アドセトリスAVD群の2年修正無増悪生存率は82.1%であり、対照群は77.2%。
※10月に末梢性T細胞リンパ腫(PTCL)に対する試験結果も公表されています。
ECHELON-2
アドセトリスを含む新規併用レジメン群が対照群であるCHOP療法群と比較して、統計学的に有意な無増悪生存期間の改善(ハザード比:0.71、p=0.0110)。アドセトリスを含む新規併用レジメン群は、CHOP群(ハザード比:0.66、p=0.0244)と比較して重要な副次評価項目である全生存期間(OS)に良好な結果が報告された。
代表的な試験は2つのみ紹介しましたが(一つはまだ論文化されていません)
ターゲットをCD30としているので、血液がん領域で複数適応を取得するものと予想されます。
末梢性T細胞リンパ腫(PTCL)など、患者数が少ない疾患でも検証されており、
治療薬がない領域なので、社会的意義は高い薬剤かと思います。
ただちょっと神経障害が強そうに見えますね。
この副作用のマネジメントがカギになりそうな薬剤です。
ALUNBRIG®︎(Brigatinib:国内未承認)
※国内未承認のため、海外サイトのリンク多めです。ご了承ください。
アリアド社を買収して得た化合物の一つです。
ALK遺伝子変異を有する肺がん患者に投与します。
この遺伝子変異の割合は3-5%程度と言われており、
爆発的な市場性はないものの、薬剤が長期奏効する可能性もあるため、
かなり長い期間にわたって服用できる可能性が高いです。
競合品はアレセンサ®︎、ザーコリ®︎、ジカディア®︎などが挙げられます。
患者数少ないながらも、アレセンサ®︎の売り上げは227 億円(2017年)なので、
今後のデータ次第では目立つ薬剤となるかもしれません。
グローバルの投資家の試算では1 billion overとありますね。
FiercePharma:Takeda’s Ariad deal pays off with blockbuster green light for Alunbrig
代表的な臨床試験
ALTA-1L試験
盲検下独立画像評価委員会の判定による無増悪生存期間中央値
ブリガチニブ群:臨床統計学的に未到達
ザーコリ群:9.8カ月
病勢進行または死亡リスクがブリガチニブ群で51%有意に減少(HR=0.49)
1年無増悪生存率
ブリガチニブ群:67%
ザーコリ群:43%
化学療法歴があった患者の無増悪生存期間中央値
ブリガチニブ群:臨床統計学的に未到達
ザーコリ群:11.0カ月
病勢進行または死亡リスクがブリガチニブ群で65%有意に減少(HR=0.35)
化学療法歴がない患者の無増悪生存期間中央値
ブリガチニブ群:臨床統計学的に未到達
ザーコリ群:9.8カ月
病勢進行または死亡リスクがブリガチニブ群で45%有意に減少(HR=0.55)
オンコロ:ALTA-1L試験結果レポート
Cabozantinib(国内未承認)
Exelixis®︎社が開発元です。
この薬剤は買収ではなくライセンス契約のようですね。
武田は自社創薬は諦めてしまったのでしょうか…
代表的な臨床試験
最新のものでは進行性肝細胞がんに対して開発が進んでいます。
CELESTIAL試験
ネクサバールによる治療期間3ヶ月未満群における全生存期間(OS)はカボザンチニブ群(N=89人)8.9ヶ月に対してプラセボ群(N=47人)6.9ヶ月(ハザード比0.72,95%信頼区間:0.47–1.10)、無増悪生存期間(PFS)は3.8ヶ月に対して1.8ヶ月(ハザード比0.35,95%信頼区間:0.23-0.52)。
ネクサバールによる治療期間3~6ヶ月群における全生存期間(OS)はカボザンチニブ群(N=98人)11.5ヶ月に対してプラセボ群(N=43人)6.5ヶ月(ハザード比0.65,95%信頼区間:0.43–1.00)、無増悪生存期間(PFS)は5.4ヶ月に対して1.9ヶ月(ハザード比0.37,95%信頼区間:0.25–0.56)。
ネクサバールによる治療期間6ヶ月以上群における全生存期間(OS)はカボザンチニブ群(N=143人)12.3ヶ月に対してプラセボ群(N=74人)9.2ヶ月(ハザード比0.82,95%信頼区間:0.58–1.16)、無増悪生存期間(PFS)は5.7ヶ月に対して1.9ヶ月(ハザード比0.48,95%信頼区間:0.35–0.67)。
オンコロ:CELESTIAL試験結果
治療歴のある進行性肝細胞がん患者さんに対するカボザンチニブ単剤療法、ネクサバールの治療期間・年齢に関係なく全生存期間(OS)、無増悪生存期間(PFS)を改善する
ネクサバール®︎投与後の検証で、プラセボ比較ながらOSで有効性が検証されました。早期中止勧告も受けています。
グローバル投資家の試算では2 billion overです。
Cabozantinib is approved in three indications but needs further entrenchment to dig a moat.
この薬剤も適応がどう広がっていくか?というところがカギですね。
また近年話題のオプジーボ®︎との併用療法でも、小野薬品と開発提携をしています。
ミクスオンライン:武田と小野 開発中のマルチキナーゼ阻害薬cabozantinibとオプジーボの併用療法開発で提携
FDAの承認は早く、2012年に甲状腺髄様がんの適応名で承認されていますね。
その後2016年進行腎細胞がんに承認されているようです。
国内でも試験を行っているようなので、今後適応が増える可能性はあります。
Niraparib(国内未承認)
PARP阻害剤です。
こちらも米国TESARO社からの導入品。
武田薬品とTESARO社による新規がん治療薬niraparibの日本における独占的開発・販売に関するライセンス契約の締結について
競合品としては同機序のリムパーザ®︎(AZ社)があります。
こちらの薬剤の予想売上高は69億円です。
代表的な臨床試験
NOVA試験
全解析対象の追跡期間中央値は16.9カ月で、主要評価項目である無増悪生存(PFS)期間中央値は、gBRCA変異陽性集団のニラパリブ群(21.8カ月)がプラセボ群(5.5カ月)と比べ有意に延長し、ハザード比(HR)は0.27であった。
gBRCA変異陰性集団のニラパリブ群(9.3カ月)もプラセボ群(3.9カ月)と比べ有意に延長し、HRは0.45であった。gBRCA変異陰性集団のうち、相同組換え修復不全(HSD)陽性集団でも、ニラパリブ群(106人、12.9カ月)がプラセボ群(56人、3.8カ月)と比べ有意に延長し、HRは0.38であった。
オンコロ:NOVA試験結果
同機序のリムパーザ®︎との差別化ができるか?といったところです。
アイクルシグ®︎(国内:大塚製薬株式会社販売)
国内承認日:2016年9月28日
国内におけるピークセールス
予測年度:10年度
予測本剤投与患者数 : 780人
予測販売金額 :29億円(ピーク時)
グローバル予想:500 million $(およそ550億円)
※国内では大塚製薬が販売しています。
参考情報として掲載します。
過去ベルケイド®︎はヤンセンファーマ社が販売していましたが、
開発元のミレニアム社を買収した際、国内の販売は両社で行った経緯がありますので、
もしかするとこの薬剤も共同販売になるかも…?

まとめ
グローバルの予測売上高は、ここにある薬剤だけで5-6billion$となりますので、
オンコロジー領域が武田を支える屋台骨になりそうです。
PI-PIIIまでの中にある開発品はほとんどがオンコロジー領域です。
完全にスペシャリティケアの分野にシフトしていると思われます。
ただ踏切が少し遅れてしまったため、
当面の開発品を買収、ライセンスインなどで賄う必要があったのでしょう。
ただ何れにしても、今後世界的にオンコロジー領域で存在感を発揮することは間違いないと思われます。
ケースケでした!
MSDのパイプラインも分析してみました
-
前の記事

【オンコロジー新薬】XPO1阻害剤selinexorとは? 2018.10.11
-
次の記事

【オンコロジーパイプライン】MSDを徹底分析してみる 2018.10.14







コメントを書く